

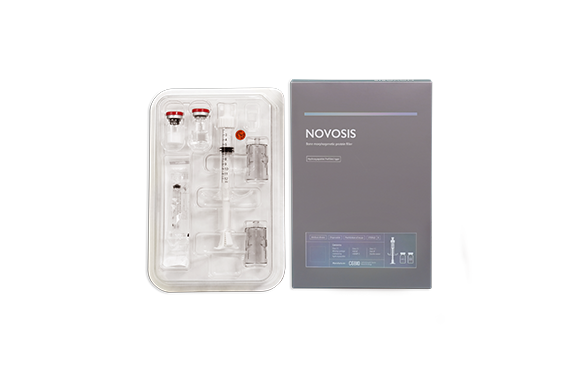
제품정보 및 사용방법
-
개요
노보시스는 하이드록시아파타이트(hydroxyapatite, Ca10(PO4)6(OH)2) 세라믹으로 구성된 합성재료이식용뼈와 유전자 재조합 뼈 형성 단백질인 Bone Morphogenetic Protein(BMP-2)이 함께 포장되어 있다.
-
제품의 구성 및 특성
본 제품은 하이드록시아파타이트(hydroxyapatite, Ca10(PO4)6(OH)2) 세라믹으로 구성된 합성골이식재와 유전자 재조합 뼈 형성 단백질인 Bone Morphogenetic Protein(BMP-2)이 일회용 주사기 및 주사침과 함께 포장되어 있으며 일회용 주사기 및 주사침을 활용하여 BMP-2의 용액을 만들고 이용액을 합성골이식재에 골고루 뿌려준 뒤 골이식에 사용한다.
-
성능
노보시스는 기공율 80% 이상을 가지는 HA표면의 90% 이상 연결된 기공을 통해 rhBMP-2가 서서히 방출된다. 척추 모델의 동물 실험 시 제품을 minipig에 이식 3개월 후 결과에서 신생골 생성률은 70%이상이며, 골전도능은 대조군 대비 1.5배로 골전도성(osteoconduction) 및 골유도성(osteoinduction)이 있었다. 후방 기기고정술 후 L1-S1의 요추 후외방 유합술 임상시험 결과 대조군인 자가장골에 비하여 이식 24주 후 방사선 사진평가에 의한 골유합율에 있어 자가장골군에 비해 임상적으로 열등하지 않음이 확인되었다.
-
사용목적
- 요추 후방기기고정술 후 L1~S1의 단분절 요추 후외방유합술에 사용
- 외상성 상하지 급성골절로 인한 5cm 이하의 골결손 부위에 자가골 이식이 불충분하거나 합병증 우려가 있는 경우 내/외 고정장치와 함께 사용
-
보관 또는 저장방법
차광된 장소에서 냉장보관 (2~8℃)
-
사용 전 준비사항
- 해당제품의 포장용기가 파손된 곳은 없는지 점검하고, 유효기간을 확인하여 멸균된 제품만을 사용하여야 한다.
- 포장 제거 후 기기의 파손 유무를 확인한다.
- 의사는 본 제품의 사용과 관련된 수술기구(Instrument)를 이용한 수술방법과 임상적응증, 금기사항 등에 대하여 완벽하게 숙지하고 있어야하며, 환자에게 적응증, 금기, 주의사항 및 발생 가능한 부작용에 대해 설명한다.
- 수술결과를 저해할 수 있는 생물학적, 생체역학적 요소가 없는지 확인한다.
- 사용설명서를 잘 숙지한 후 사용한다.
-
시술 전
일반적인 사용방법- 본 제품을 시술에 사용하기 전에 제품 내에 포장되어 있는 주사기와 주사침을 이용하여 유전자 재조합 뼈 성장 단백질에 포함되어 있는 용제부의 주사용수를 뽑아낸다.
- 뽑아낸 주사용수를 주성분(rhBMP-2)이 담겨진 바이알에 넣고 바이알을 부드럽게 원을 그리며 흔들어 혼합한다. 과도하게 흔들면 안된다.
- 멸균된 스테인리스 바트 등에 합성골이식재를 부은 뒤 주성분과 주사용수가 혼합된 액을 사용하지 않은 주사기와 주사침을 이용하여 골고루 뿌린 후 시술에 사용한다.
-
시술방법
요추 후방기기고정술 후 L1~S1의 단분절 요추 후외방유합술- 전신 마취하에 엎드린 자세에서 해당되는 척추를 포함해 넓게 소독을 한 후 무균 수술포로 도포한다
- 해당 척추 분절의 극돌기 위로 종절개를 가한 후 피하 및 근막을 노출시킨다.
- 극돌기 측면을 따라 지혈을 하면서 골막하 박리를 한다.
- 유합술을 시행하려는 척추의 후궁과 후관절을 노출시키며 이때 유합하려는 분절 이외의 후관절을 손상시키지 않도록 주의하면서 위, 아래 횡돌기를 박리한다.
- 해당 분절의 후방 인대 복합체를 제거하고 상, 하 극돌기의 1/2 정도를 제거한다.
- 후궁을 조심스럽게 제거하고 황색인대 등 경막을 압박하는 조직을 제거한다.
- 경막을 노출시키고 신경근 주위의 비후된 후관절과 황색인대, 추간판 등을 제거하여 신경근을 압박하는 조직이 없는 것을 확인한다. 노출시킨 양측 횡돌기, 후궁 외벽 및 척추 경 외벽을 절삭기 등을 이용하여 피질골을 일부를 제거하며 이 때 횡돌기가 부러지지 않도록 주의한다.
- 해당 척추의 척추경에 K-강선을 삽입하고 방사선 촬영을 통해 정확한 위치를 확인한 후 척추경 나사못을 삽입한다.
- 척추경 나사못 삽입시 awl로 구멍을 낸 후 T자 삽입기를 척추경 내강에 삽입하고 적절한 위치에 있는지 확인기를 통해 척추경의 내벽을 확인하면서 척추경 나사못의 길이를 결정한다. 나사못의 길이는 전방 추체에 미치지 못하는 길이로 한다.
- 수술 도중에 지혈을 하고 생리식염수로 세척을 하고 척추경 나사못을 삽입한다.
- rhBMP-2가 함유된 골이식재인 본 제품 3g(약8cc에 해당)을 상하횡돌기와 후궁 외벽 및 척추경 외벽에 이식하며 이 때 rhBMP-2가 함유된 골이식재가 경막이나 신경근에 직접 닿지 않도록 주의한다.
- 반대쪽 횡돌기, 후궁 외벽 및 척추경 외벽에도 동일한 방법으로 이식한다.
- 이식이 끝나면 척추경 나사못과 금속 강봉을 연결하여 튼튼하게 결합시키고, 배혈관을 삽입한 후 층층히 봉합한다. (환자의 상태 및 시술자에 따라 세부 시술법은 달라질 수 있다.)
-
시술방법
외상성 상하지 급성골절로 인한 골결손- 이식할 부위를 건조한 상태로 하기 위해 지혈을 한다.
- 이식된 재료는 과도하게 넣어서는 안 되며, 응력이 가하지 않도록 상처부위를 닫아야 한다.
- 본 제품은 기계적 안정을 필요하는 곳이나 공간을 채우는 용도로 사용하면 안되며, 적절한 골절수복 후 사용하여야 한다.
- 본 제품을 이식시 분쇄 부위를 연결하고 주요 골절부위 및 distal fragments와 잘 위치하도록 이식하며, 골절로 인한 골결손 부위에 따라 이식재를 적절히 이식한다.
- 시술할 골결손 부위에 본 제품의 과립을 소독 완료된 의료용 핀셋, 스푼 등을 이용하여 과도한 힘이 가해지지 않도록 주의하여 채워 넣는다. 만약 시술 부위에 필요 이상의 과립이 충전된 경우 잉여의 과립은 제거한다.
- 골결손 부위에 골수내고정막대 및 골절합용판 등 내/외고정장치를 함께 사용하여 확실히 고정한다.
- 이식 후 상처부위는 세척하지 않으며 수술용 배혈관이 필요한 경우, 최대한 이식부위와 먼 부위에 삽입하고 연조직은 완벽히 봉합한다.
-
사용 후 보관 및 관리방법
본 제품은 멸균 제품이므로 개봉 후 즉시 사용해야 하며, 사용하고 남은 제품을 보관한 다음 재사용해서는 안 된다.
주의사항
-
경고
다음의 환자에게는 본 제품사용을 금지한다.
- 임신 중인 환자
- rhBMP-2에 과민성을 보이는 환자
- 수술절개 부위에 감염이 있는 환자
- 이식부위에 종양을 제거한 환자
- 항암치료중인 환자
- 골격 미성숙 [18세 미만이나 epiphyseal closure(성장판 폐쇄)가 영상학적으로 확인되지 않은] 환자
의료기기의 특성상 다음과 같은 환자에게는 본 제품을 사용하지 않는다.
- Hydroxyapatite, BMP-2에 과민반응 기왕력이 있는 자
- 조절되지 않는 당뇨병 또는 고혈압 환자이거나 혈액응고 이상자
- 18세 미만의 환자에게 사용할 경우 과도한 골형성 및 성장에 변화를 주어 골격발달에 부정적인 영향을 미칠 수 있으므로, 심각한 골결함 또는 희귀 골장애가 있는 18세 미만 환자에게는 사용금지를 권장한다.
-
경고 – 후방기기고정술 후 L1~S1 요추 후외방유합술
- 유합술을 시행하려는 척추의 후궁과 후관절을 노출시키며 이 때 유합하려는 분절 이외의 후관절을 손상시키지 않도록 주의하면서 위, 아래 횡돌기를 박리한다.
- 경막을 노출시키고 신경근 주위의 비후된 후관절과 황색인대, 추간판 등을 제거하여 신경근을 압박하는 조직이 없는 것을 확인한다. 노출시킨 양측 횡돌기, 후궁 외벽 및 척추경 외벽을 절삭기 등을 이용하여 피질골을 일부 제거하며 이때 횡돌기가 부러지지 않도록 주의한다.
- rhBMP-2가 함유된 골이식재인 본 제품 3g(약 8cc에 해당)을 상하 횡돌기와 후궁 외벽 및 척`추경 외벽에 이식하며, 이 때 rhBMP-2가 함유된 골이식재가 경막이나 신경근에 직접 닿지 않도록 주의한다.
- 후외방 유합술시 사용하는 척추경 나사못 및 rod의 재질인 타이타늄, 타이타늄 합금 및 PEEK(polyetheretherketone)과 관련된 알레르기가 있는 환자에게는 사용하면 안된다.
-
경고 – 외상성 상하지 급성골절로 인한 골결손
- 자가골 이식이 불충분하거나 합병증 우려가 있는 경우 사용하며 내/외 고정장치인 골수내고정막대 및 골절합용판과 함께 사용한다.
- 악성 종양이 있거나 활동성 악성 종양이 있는 환자 또는 악성 종양 치료를 받는 환자에게서 절제되거나 현존하는 종양 부근에 사용 되어서는 안된다.
- 골격이 미성숙(<18세 또는 근절막 폐쇄의 방사선학적 증거 없음)인 경우, 뼈 이식편을 사용해서는 안 된다.
- 부적절한 신경혈관상태(e.g.높은 위험도가 있도 절단)가 있는 환자에게는 사용하지 않아야 한다.
- 사지(limb)의 영향을 받는 구획증후군 환자에게 사용해서는 안 된다.
- 수술 부위에서 활동성 감염이 있는 환자에게는 이식되면 안 된다.
-
치명적 부작용
본 제품의 임상시험 중 발견된 치명적 부작용은 없으며 다만, 일반적인 구강시술에서 발생할 수 있는 이상반응 이외에 본 제품의 사용으로 인한 아래의 이상 반응을 예측할 수 있다.
신경학적 합병증; 신경 및 척수 손상, 경막 손상, 성 기능·배변 기능의 이상 등
신경을 포함한 주변조직의 염증반응
rhBMP-2 관련 FDA 부작용 보고; 연하 장애, 지주막염, 신경마비, 역행성사정, 종양발생의 증가 등
삽입물과 관련된 합병증; 삽입물 이완, 이동, 척추간 추간판 공간거리 감소 등 이식물질에 알레르기 반응
- 수혈 필요할 수 있는 출혈
- 과도한 혹은 의도하지 않은 부위의 정상적이지 않은 골 형성
- 조직이나 신경 부위의 손상
- 사망
- 태아 발달 합병증
- 감염
- 통증 혹은 불편함
- 피부의 부어오름이나 자극
- 호흡 곤란
- 반흔 형성이나 외과적 절개에 따른 다른 증상
- 발진 또는 알레르기 반응
- 마취나 외과적 접근에 따른 부작용
- 흉터 형성
- 절개에 따른 합병증
-
이상반응
(후방기기고정술 후 L1~S1 요추 후외방유합술 임상시험시 이상반응) 임상시험 중 다음과 같은 이상반응이 관찰되었다. 회복되었으나 후유증이 있는 이상반응이었으며 그 중 2건은 ‘Radiating pain, L/Ex Rt. Only’와 ‘Urticaria’으로 확인하였다. ‘Radiating pain, L/Ex Rt. Only’의 중증도는 ‘경증’이었으며 국소반응으로 해당 이상반응은 임상시험계획서내 예측되는 이상반응으로 분류되어 있긴 하나, 본 임상시험의 특성상 수술로 인한 통증도 배제할 수 없을 것으로 판단된다. ‘Urticaria’의 경우는 중증도는 ‘중등증’ 이었으며 전신반응으로 나타나 본 임상시험의 시험약인 Novosis의 유사 제품인 Novosis-dent의 사용시 주의사항을 근거로 보았을 때 해당 이상반응은 이식물질에 따른 알레르기 반응임을 배제할 수 없을 것으로 판단된다.
- 위장병
- 변비
- 발열
- 근골격계 및 결합조직 장애
- 허리 통증
- 사지 통증
- 부종
-
일반적 주의
- 척추수술 및 골절수술을 시행할 수 있는 숙련된 외과의사의 경우에만 본 제품을 사용할 수 있다.
- 면역반응을 일으킬 수 있으므로 주의한다.
- 태아에 영향을 줄 수 있으므로 가임기 여성의 경우 수술 후 1년 동안 피임 하도록 경고한다.
-
상호작용
흡연이나 음주, NSAID 계통, Steroid 계통, Bisphosphonate 계통의 의약품을 사용할 경우 본제품의 효능이 저하될 수 있다.
-
임부수유부 등에 대한 사항
임신 및 수유부에게는 사용을 금한다. 가임기 여성은 시술 후 1년 이내에 임신을 되도록 피한다.
-
적용상의 주의
- 시술 전 해당제품의 포장용기가 파손된 곳은 없는지 점검하고, 유효기간을 확인하여 멸균된 제품만 사용한다
- 이식 시 과도한 응력이 가해지지 않도록 한다.
- 이식 후 상처부위를 세척하지 않는다.
- 수술시 BMP-2 용량은 6mg를 초과하여 사용하지 않는다. * rhBMP-2 side당 3mg 사용 *임상시험계획 승인번호 제 237호
-
용법 및 관리
- BMP-2 및 골이식재는 사용 전에 준비하며, 완제품 기준의 혼합 분량은 1g : 1mg(합성재료이식용뼈 : 유전자재조합뼈형성단백질)이며, rhBMP-2의 농도는 1mg/ml(주성분부/용제부)이다.
(rhBMP-2 용량은 6mg를 초과하여 사용할 수 없다.) - 사용할 부위에 맞는 용량을 사용하며, 사용방법에 설명된 방식으로 혼합하여 사용한다. 사용방법에 기재되지 않은 저장방법, 혼합 및 관리는 예상치 못한 부작용을 초래할 수도 있다
- BMP-2 및 골이식재는 사용 전에 준비하며, 완제품 기준의 혼합 분량은 1g : 1mg(합성재료이식용뼈 : 유전자재조합뼈형성단백질)이며, rhBMP-2의 농도는 1mg/ml(주성분부/용제부)이다.
INSTRUCTION
| 분류(형명) | 구성 | 주성부분에 주입되는 주 사용수 량 |
|||
|---|---|---|---|---|---|
| 골이식재 | 주성분부 (rhBMP-2) |
주사용수 | |||
| 입자크기(mm) | 용량(g) | ||||
| BMPGM025 | 0.6~1.0 | 0.25g x 1vial | 0.25mg x 1vial | 1.0ml x 1 vial | 0.25ml / 주성분부1vial |
| BMPGM050 | 0.6~1.0 | 0.5g x 1vial | 0.50mg x 1vial | 1.0ml x 1 vial | 0.5ml / 주성분부1vial |
| BMPGM100 | 0.6~1.0 | 0.5g x 1vial | 0.50mg x 2vial | 1.0ml x 2 vial | 0.5ml / 주성분부1vial |
| BMPGL050 | 0.6~1.3 | 0.5g x 1vial | 0.50mg x 1vial | 1.0ml x 1 vial | 0.5ml / 주성분부1vial |
| BMPGL100 | 0.6~1.3 | 1.0g x 1vial | 0.50mg x 2vial | 1.0ml x 2 vial | 0.5ml / 주성분부1vial |
| BMPGL101 | 0.6~1.3 | 0.5g x 1vial | 0.50mg x 2vial | 1.0ml x 2 vial | 0.5ml / 주성분부1vial |
이 제품은 ‘의료기기’이며, ‘사용상의 주의사항’과 ‘사용방법’을 잘 읽고 사용하십시오.

①포장된 골이식재를 멸균 된 트레이에 담는다.
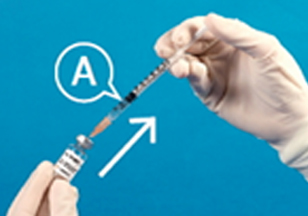
②주사용수를 ⓐ주사기를 사용하여 모두 뽑아낸다.
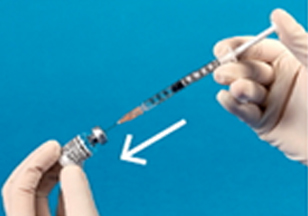
③뽑아낸 주사용수를 각 형명의 BMP-2 단백질 부용량에 맞게 주사용수를 주입한다.
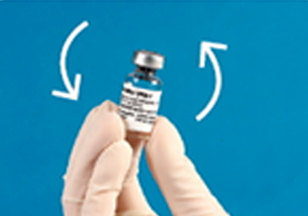
④BMP-2가 용해되도록 조심스럽게 흔든다.
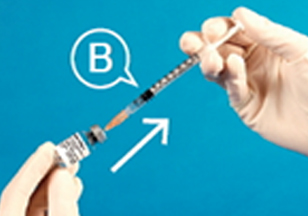
⑤완전히 용해된 BMP-2 용액을 ⓑ주사기를 사용하여 완전히 뽑아낸다.
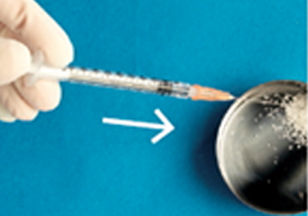
⑥뽑아낸 BMP-2를 모두 골이식재에 고르게 뿌려준다. 10분 후 골 이식한다.